Азот технический
Содержание:
- Открытие[править | править код]
- Литература
- Фиговое дерево в поэзии[править]
- Воздействие азота на окружающую среду
- Соединения азота
- Природные источники азота для растений
- Почему не цветет орхидея, а растут только листья и корни.
- Азот в жизни растений
- Современные сфера применения азота в качестве технического газа
- Как правильно ухаживать?
- Примечания
- Разновидности удобрений, содержащих азот
- N2
- Описание
- Литература
- Минеральные удобрения с нитратной формой азота
- [править] Химические свойства
- Промышленное производство
- Применение
- Ссылки
- Получение и применение азота
- Влияние на сельскохозяйственные культуры
- [править] История открытия
- Характеристики азота
- Количество азота в различных видах удобрений
- Население
Открытие[править | править код]
В 1777 году Генри Кавендиш провёл следующий опыт: он многократно пропускал воздух над раскалённым углём, затем обрабатывал его щёлочью, в результате получался остаток, который Кавендиш назвал удушливым (или мефитическим) воздухом. С позиций современной химии ясно, что в реакции с раскалённым углём кислород воздуха связывался в углекислый газ, который затем реагировал со щёлочью. При этом остаток газа представлял собой по большей части азот. Таким образом, Кавендиш выделил азот, но не сумел понять, что это новое простое вещество (химический элемент). В том же году Кавендиш сообщил об этом опыте Джозефу Пристли.
Литература
- Некрасов Б. В. Основы общей химии. Т. 1. — М.: Химия, 1973;
- Химия: Справ. изд. / В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.; Пер. с нем. — 2-е изд., стереотип. — М.: Химия, 2000. — ISBN 5-7245-0360-3 (рус.), ISBN 3-343-00208-9 (нем.);
- Ахметов Н. С. Общая и неорганическая химия. — 5-е изд., испр. — М.: Высшая школа, 2003. — ISBN 5-06-003363-5;
- Гусакова Н. В. Химия окружающей среды. — Ростов н/Д: Феникс, 2004. — ISBN 5-222-05386-5. — (Высшее образование).
- Исидоров В. А. Экологическая химия. — СПб: Химиздат, 2001. — ISBN 5-7245-1068-5;
- Трифонов Д. Н., Трифонов В. Д. Как были открыты химические элементы. — М.: Просвещение, 1980;
- Справочник химика. — 2-е изд. — Т. 1. — М.: Химия, 1966.
Фиговое дерево в поэзии[править]
Воздействие азота на окружающую среду
Высокие концентрации нитратов и нитритов попадают в окружающую среду в результате деятельности человека, в основном из-за широкого использования удобрений. Во время процессов горения также выделяются оксиды азота, которые затем повышают концентрацию нитратов и нитритов в результате определенных реакций.
Эти соединения азота оказывают разнообразное воздействие на окружающую среду. Во-первых, они влияют на видовой состав, поскольку устойчивость к соединениям азота варьируется от вида к виду. Более того, нитриты вредны для здоровья людей и животных. Богатые азотом пастбищные корма снижают перенос кислорода в кровь, что, в частности, отрицательно сказывается на животноводстве.
Соединения азота
Степени окисления азота в соединениях −3, −2, −1, 0, +1, +2, +3, +4, +5.
- Соединения азота в степени окисления −3 представлены нитридами, из которых практически наиболее важен аммиак;
- Соединения азота в степени окисления −2 менее характерны, представлены пернитридами, из которых самый важный пернитрид водорода N2H4, или гидразин (существует также крайне неустойчивый пернитрид водорода N2H2, диимид);
- Соединения азота в степени окисления −1: NH2OH (гидроксиламин) — неустойчивое основание, применяющееся, наряду с солями гидроксиламмония, в органическом синтезе;
- Соединения азота в степени окисления +1: оксид азота (I) N2O (закись азота, веселящий газ), азотноватистая кислота;
- Соединения азота в степени окисления +2: оксид азота (II) NO (монооксид азота), азотноватая кислота;
- Соединения азота в степени окисления +3: оксид азота (III) N2O3 (сесквиоксид азота, триоксид диазота), азотистая кислота, производные аниона NO2−, трифторид азота (NF3);
- Соединения азота в степени окисления +4: оксид азота (IV) NO2 (диоксид азота, бурый газ);
- Соединения азота в степени окисления +5: оксид азота (V) N2O5 (пентаоксид диазота), азотная кислота, её соли — нитраты и другие производные, а также тетрафтораммоний NF4+ и его соли.
Природные источники азота для растений
В естественной среде азот никуда не теряется. Он циркулирует по кругу, и как бы буйно не росли деревья и травы в поле или в лесу, азота им хватает. Круговорот этого элемента в природе осуществляется по такой схеме:
- растения выносят азот из почвы и используют для построения своих белковых молекул и аминокислот;
- животные поедают растения и переносят азот из их клеток в свои для построения собственных белков и аминокислот;
- животные и растения умирают, подвергаются разложению почвенными микроорганизмами, которые превращают их останки в гумус, затем минерализуют и возвращают азот в почву.
На самом деле, схема круговорота азота сложнее, но даже такой упрощённый вариант объясняет, почему «дикие» земли не истощаются. Более того, чем дольше существует природное сообщество, тем богаче азотом и другими элементами становится почва.
Совсем иначе обстоят дела на «культурных», сельскохозяйственных землях. Традиционная агротехника подразумевает полную уборку пожнивных остатков, тщательную прополку сорняков и вынос зелёной массы с поля или грядки. Земля вспахивается или глубоко перекапывается с оборотом пласта, в результате чего гибнут почвенные микроорганизмы. Процесс круговорота азота останавливается. Высаженные культуры забирают питание из почвы, но ничего в неё не возвращают.
В природе азот растениям предоставляют почвенные бактерии, которые «добывают» его из органических остатков и воздуха. При высокой микробиологической активности почвы, с высоким содержанием в ней органики, потребность во внесении удобрений стремится к минимуму.
Почему не цветет орхидея, а растут только листья и корни.
Азот в жизни растений
При низком азотном обеспечении уровень хлорофилла в листе снижается, лист теряет зеленую окраску, приобретает светло-зеленый окрас, заметно сокращается размер пластинки, снижается рост ветвей и побегов. Кроме того, растения становятся восприимчивы к стрессовым условиям внешней среды (например: ветер, засуха).
Растение использует в питании преимущественно минеральные соединения азота, в виде солей аммония и нитратов. Свободный азот воздуха растение (кроме представителей семейства Бобовых) усваивать не может. Представители семейства Бобовых используют атмосферный азот через жизнедеятельность клубеньковых бактерий растущих на корнях.
Современные сфера применения азота в качестве технического газа
Азот сегодня широко используется в виде газа и жидкого раствора во многих отраслях промышленности. который перед применением переводят в газообразное состояние при помощи специального оборудования — газификатора. Используется технический азот для обеспечения безопасности работы с легковоспламеняющимися веществами, в установках пожаротушения и для создания определенной среды, необходимой для осуществления технологических процессов.
Технический азот сегодня широко востребован в:
- нефтегазовой промышленности,
- нефтехимической и химической индустрии,
- фармацевтике,
- металлургии,
- стекольной промышленности,
- при производстве электроники,
- обработке отходов,
- упаковке продуктов питания и пр.
Как видите, характерные особенности данного технического газа сегодня востребованы практически во всех отраслях. Мы разрабатываем и производим установки для разделения газов с 2001 года. За время своей деятельности мы успели полностью изучить спрос на него в современной промышленности. Поэтому сегодня готовы предложить оборудование для всех существующих областей его применения.
Преимуществом выбора НПК «Грасис» является индивидуальный подход к выполнению каждого заказа, который обеспечивает строго соответствие параметров и характеристик оборудования требованиям клиента. Если вас интересует оборудование для получения технического азота, обращайтесь в НПК «Грасис» — мы его изготовим, установим и будем в дальнейшем обслуживать!
Более подробно Вы можете ознакомиться с азотным оборудованием (азотные генераторы, азотные установки, азотные станции) на странице www.grasys.ru.
Как правильно ухаживать?
Космея считается довольно неприхотливым цветком, когда речь идет об уходе – она обладает отличным иммунитетом, который позволяет растению цвести даже на обедненном грунте без регулярного ухода садовода. Весь процесс ухода за цветками космеи сводится к поливам, подкормкам, рыхлению и декоративной обрезке.
Полив
Космея относится к садовым культурам, которые плохо удерживают влагу у корней, а потому полив этого растения должен быть не только обильным, но и частым. Молодые саженцы поливаются через каждые 2-3 дня, более взрослые кустики – 1 раз в неделю или по мере высыхания земляной корки в приствольном круге цветка.
На полив одного взрослого куста космеи должно уходить около 4 десятилитровых ведер отстоявшейся воды. Воду нужно вносить исключительно под корни, так как при поливе лейкой есть шанс гниения побегов цветка и ожогов от солнца. Саму процедуру полива лучше проводить ранним утром или вечером.
Подкормка
Витаминные подкормки вносятся в грунт к космее 3 раза за сезон. Самая первая подкормка проводится через 14-15 дней после высадки саженцев на постоянное место – сюда лучше всего подойдут комплексные минеральные удобрения. Вторую подкормку проводят в период образования бутонов. Третья и последняя подкормка должна проводиться в период цветения космеи – для более насыщенного цвета бутонов и продления цветения.
Если говорить об определенных удобрениях, то для стимуляции цветения и образования пышных бутонов лучше всего подойдет «Бутон», а вот в роли оптимальной минеральной подкормки на весь сезон себя отлично показал препарат «Агрикола». Неплохо космея относится и к органическим удобрениям, однако они не должны вноситься в грунт в свежем виде – это относится к компосту или навозу.
Органические подкормки обычно вносятся в грунт к космее или служат в качестве мульчированного слоя, а вот минеральные удобрения обычно смешиваются с водой для полива растения и могут быть поданы под корни цветка или опрысканы поверх его побегов.
С удобрениями главное – не переборщить: избыток витаминов в почве может привести к увяданию цветка или снижению количества бутонов.
Обрезка и рыхление
Чтобы кусты космеи более длительный срок сохраняли декоративный вид, их сухие и отцветшие бутоны советуется сразу же удалять – это простимулирует рост других бутонов и продлит период цветения.
Некоторые сорта космеи отличаются излишней кустистостью, а потому молодые побеги космеи иногда прищипываются еще до периода активного роста – у многолетних сортов это обычно делается ранней весной. Декоративный вид цветка поможет поддержать регулярная стрижка. Во время этой процедуры советуется удалять не более 30 см от молодых и взрослых побегов.
Еще одним важным этапом в уходе за космеей является рыхление земли в приствольном круге возле цветка. Это не только облегчает грунт, но и делает его более воздушным, что позволяет кислороду и влаге беспрепятственно доходить до корней цветка.
Зимовка
Если вы собираетесь выращивать у себя в саду многолетнюю космею, то осенью, до наступления первых заморозков, цветок нужно правильно подготовить к зимовке. Опытные садоводы срезают все побеги и бутоны космеи до уровня в 10-15 см над землей, а затем укрывают слоем лапника, который защитит цветок от мороза и тяжелого снега. Палую листву для укрытия лучше не использовать – в ней предпочитают зимовать личинки многих садовых вредителей. Чтобы сохранить корни цветка от промерзания, в приствольном круге обязательно организуется слой мульчи из соломы, торфа, перепревшего навоза, опилок или древесной коры.
С наступлением первых теплых весенних дней укрытие с космеи убирается, чтобы цветок не сопрел под солнечными лучами.
Если многолетняя космея выращивается в южных регионах с продолжительными и суровыми зимами, то цветок на период зимовки лучше всего выкопать и вместе с земляным комом пересадить во временный горшок, где он будет храниться до наступления тепла.
Примечания
- Комментарии
- В это время филистимляне проводили активную завоевательную политику в Палестине, что в конце концов привело к столкновениям с израильтянами, также претендующими на господство в регионе. При этом у филистимлян было неоспоримое преимущество, поскольку израильтяне не умели обрабатывать железо. Тем не менее, в первой половине X века до н. э., во время правления царя Соломона, Филистия некоторое время была вынуждена платить дань Израилю.
- В Израиле поселению присваивается статус города, когда его население переваливает за 20 тысяч.
- Источники
- ↑
- ↑ — статья из
- .
- ↑
- ↑ (недоступная ссылка). Дата обращения: 19 февраля 2010.
- ↑ — статья из
- .
- (иврит). Центральное статистическое бюро Израиля. Дата обращения: 25 января 2021.
- ירון דרוקמן. (иврит). Ynet (11.11.19). Дата обращения: 19 января 2021.
- ↑ (иврит). www.cbs.gov.il. הלשכה המרכזית לסטטיסטיקה (2018). Дата обращения: 20 ноября 2020.
- .
- .
- .
- (недоступная ссылка). nordportal.ru (25 июня 2012). Дата обращения: 25 июня 2012.
- (недоступная ссылка). Дата обращения: 17 марта 2013.
- (рус.) (неопр.) ? (18.04.2013). Дата обращения: 24 апреля 2013.
Разновидности удобрений, содержащих азот

Классифицируют удобрения по двум основным признакам.
По агрегатному состоянию:
- твердое — в виде гранул, применяется, как правило, в весенне-летний период из-за быстрого вымывания из почвы;
- жидкое — в виде растворов, легко усваиваются растениями и равномерно распределяются в почве.
По действующему компоненту, в котором содержится азот:
 Аммиачные — на основе аммония:
Аммиачные — на основе аммония:
- Аммиачная селитра — 35% (N), широко применяется в весенне-летний период для основного удобрения и подкормки, выпускается в виде белых гранул. Не рекомендуется для переувлажненных участков из-за быстрого вымывания. Хорошо укрепляет стволовую часть и развивает листья. Сильно окисляет почву, поэтому применяется с нейтрализаторами.
- Сульфат аммония — 20,5% (N), может применяться осенью и весенне-летний периоды для основного питания и подкормок, выпускается в гранулах. Также требует добавления нейтрализатора (мела, извести). Прекрасно зарекомендовал себя как подкормка для картофеля.
- Хлористый аммоний — 25% (N), абсолютно не слеживается при хранении, легко усваивается всеми видами растений, вносить можно только осенью как основное удобрение из-за содержания хлора. Для подкормки не используется.
 Нитратные — на основе нитратных соединений:
Нитратные — на основе нитратных соединений:
- Калийная селитра (нитрат калия) — 13% (N), производится в виде порошка или кристаллов, используется для кислых почв в качестве нейтрализатора. Хорошо подходит для подкормки в весенне-летний период, укрепляет корневую систему. Легко растворяется в воде, поэтому требует особых условий хранения и упаковки (герметически запакованные целлофановые мешки).
- Натриевая селитра (нитрат натрия) — 16% (N), выпускается в виде кристаллического порошка, хорошо растворяется в воде, применяется в виде подкормки для корнеплодов. Подходит для всех видов почв, рекомендуется для внесения ранней весной при посеве культур. Особенно эффективна в кислых почвах, выступая щелочным нейтрализатором.
- Кальциевая селитра (нитрат кальция) — 13%(N), выпускается в форме гранул и кристаллов, хорошо растворяется в воде, подходит для всех видов грунта. Кальций облегчает процесс усвоения азота растениями и особенно помогает развитию корневой системы.
 Амидные — органическое соединение на основе аммиака и углекислого газа:
Амидные — органическое соединение на основе аммиака и углекислого газа:
Мочевина (карбамид) — 46% (N), выпускается в виде гранул в защитной пленке, предотвращающей слеживание. Отлично подходит для всех видов почв, особенно для увлажненных, так как обладает стойкостью к вымыванию из почвы. Не вызывает ожогов листьев, поэтому отлично подходит для подкормки.
Мочевину рекомендуется вносить в комплексе с калийными удобрениями из-за содержания биурета — токсичного вещества, оказывающего негативное действие на растения.
N2
Три неспаренных р-электрона атома азота, лежащие на его внешнем энергетическом уровне, имеют форму равноплечей восьмерки, располагаясь перпендикулярно друг к другу:
При образовании молекулы азота (N2) p-орбиталь, расположенная по оси X, одного атома, перекрывается с аналогичной px-орбиталью другого атома — в месте пересечения орбиталей образуется повышенная электронная плотность с формирование ковалентной связи (σ-связь).
Две другие орбитали одного атома, расположенные по осям Y и Z, перекрываются боковыми поверхностями со своими «собратьями» другого атома, образуя еще две ковалентные связи (π-связи).
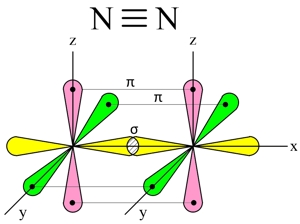
В итоге, в молекуле азота (N2) образуются 3 ковалентные связи (две π-связи + одна σ-связь), т. е., возникает очень прочная тройная связь (см. ).
Молекула азота очень прочная ( 940 кДж/моль), обладает низкой реакционной способностью.
Описание
Литература
- Некрасов Б. В., Основы общей химии, т. 1, М.: «Химия», 1973;
- Химия: Справ. изд./В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. 2-е изд., стереотип. — М.: Химия, 2000 ISBN 5-7245-0360-3 (рус.), ISBN 3-343-00208-9 (нем.);
- Ахметов Н. С., Общая и неорганическая химия. 5-е изд., испр. — М.: Высшая школа, 2003 ISBN 5-06-003363-5;
- Гусакова Н. В., Химия окружающей среды. Серия «Высшее образование». Ростов-на-Дону: Феникс, 2004 ISBN 5-222-05386-5;
- Исидоров В. А., Экологическая химия. СПб: Химиздат, 2001 ISBN 5-7245-1068-5;
- Трифонов Д. Н., Трифонов В. Д., Как были открыты химические элементы — М.: Просвещение, 1980
- Справочник химика, 2-е изд., т. 1, М.: «Химия», 1966;
Минеральные удобрения с нитратной формой азота
К нитратным минеральным удобрениям относятся следующие соли:
- Кальциевая селитра. Легкорастворимое соединение, пригодное для быстрых корневых подкормок в виде водного раствора на кислых грунтах. Для приготовления раствора берётся 20-30 г селитры на 10 л воды. Растения поливаются в начальной фазе вегетации с интервалом 15 дней. Узнайте более подробно → применение кальциевой селитры как удобрение, как разводить и поливать.
- Натриевая (натронная) селитра. Популярное удобрение для весеннего основного внесения в почву. Ощелачивает кислый грунт. Вносится при весенней обработки почвы по 40 г на 1 м2. Узнайте более подробно → как использовать натриевую селитру в качестве подкормки + отзывы.
Нитратные удобрения широко используются сельскохозяйственными производителями в средней полосе России, где преобладают кислые подзолы. В зоне Черноземья эти соли неэффективны.
[править] Химические свойства
Азот входит в главной подгруппы пятой группы периодической системы Менделеева. Порядковый номер его 7. Атомы азота имеют во внешней электронной оболочке пять электронов. Поэтому они могут присоединять три электрона, которых им не хватает для образования полностью заполненной восемью электронами оболочки, и восстанавливаться до ионов N 3 или терять пять валентных электронов, превращаясь в положительно заряженные ионы и проявляя при этом свою максимальную положительную валентность. Атомы азота также могут терять и меньшее количество электронов, проявляя при этом положительную валентность 1+, 2+, 3+ и 4+.
Молекулы азота двухатомные, оба атома прочно связаны между собой тремя общими электронными парами.
Чтобы разложить молекулу азота на атомы, надо потратить значительное количество энергии. Поэтому азот при обычных условиях химически довольно пассивный.
При высоких температурах, когда молекулы азота разлагаются и он переходит в атомарное состояние, он сравнительно легко вступает в реакции с металлами (особенно с активными), образуя так называемые нитриды. При высокой температуре, высоком давлении и наличии катализатора оксид соединяется с водородом с образованием аммиака. При температуре электрической искры (свыше 3000 °C) азот реагирует с кислородом, образуя неустойчивый при высокой температуре монооксид азота NO по реакции:
N2 + O2 = 2NO
В природе эта реакция происходит при грозовых разрядах.
Другие свойства
В обычных условиях азот физиологически инертен, но при вдыхании сжатого воздуха наступает состояние, называемое азотным наркозом, подобное алкогольному опьянению. Эти случаи могут быть при условии водолазных работ на глубине нескольких десятков метров. Для предупреждения возникновения данного состояния порой пользуются искусственными газовыми смесями, в которых азот заменен гелием или иным инертным газом. При резком и значительном снижении парциального давления азота, растворимость его в крови и тканях настолько уменьшается, что часть его выделяется в виде пузырьков, является одной из причин возникновения кессонной болезни, которая наблюдается у водолазов при быстром их поднятии на поверхность и у пилотов при больших скоростях взлета самолета, а также при входе в верхние слои атмосферы.
В смеси с кислородом азот используется как слабый наркотик, вызывающий состояние опьянения, эйфории, притупление болевой чувствительности. Используется для ингаляционного наркоза.
Промышленное производство
В настоящее время в основном используют три технологии для получения инертного азота, основанные на разделении атмосферного воздуха:
- криогенная;
- мембранная;
- адсорбционная.
Разделяющие криогенные установки функционируют по принципу сжижения воздуха. Сначала он сжимается компрессором, затем проходит через теплообменники и расширяется в детандере. В результате охлажденный воздух становится жидкостью. За счет разной температуры кипения кислорода и азота происходит их разделение. Процесс многократно повторяется на специальных ректификационных тарелках. Завершается он получением чистейшего кислорода, аргона и азота. Данный способ наиболее эффективен для крупных предприятий по причине значительных габаритов системы, сложности ее пуска и обслуживания. Достоинство метода состоит в том, что можно получить азот наивысшей чистоты, как жидкий, так и газообразный, в любых количествах. При этом расход энергии на изготовление 1 л вещества составляет 0,4-1,6 кВт/ч (в зависимости от технологической схемы установки).
Мембранная технология разделения газов начала применяться в 70-х годах прошлого века. Высокая экономичность и эффективность данного метода послужила достойной альтернативой криогенному и адсорбционному способам получения чистого азота. Сегодня в установках используются мембраны последнего поколения высокой производительности. Теперь это не пленка, а тысячи полых волокон, на которые нанесен селективный слой. Подвижные составляющие в установке отсутствуют, поэтому значительно увеличивается продолжительность ее эксплуатации без поломок. Отфильтрованный воздух подается в систему. Кислород беспрепятственно проходит сквозь нее, а азот выводится под давлением через противоположную сторону мембраны и направляется в накопитель. С помощью данных установок изготавливается вещество с чистотой до 99,95%. Таким образом осуществляется производство азота из атмосферного воздуха. Ограниченная чистота получаемого азота не позволяет применять данный метод крупным изготовителям с большими потребностями высокочистого азота.
На тех предприятиях, где востребован азот высокой чистоты в больших объемах, применяется установка для разделения газовых смесей при помощи адсорбентов. Конструктивно она представляет собой две колонны. В каждой из них находится вещество, селективно поглощающее газовую смесь. Для функционирования установок по производству азота требуется атмосферный воздух, электроэнергия.
Изначально воздух попадает в компрессор, где происходит его сжатие. Затем он подается в ресивер, который выравнивает его давление. Так как воздух не должен содержать водяных паров, пыли, двуокиси углерода, окислов азота, ацетилена, а также других примесей, его фильтруют. Наступает основной этап адсорбционного разделения газовой смеси. Поток воздуха пропускается через одну колонну с углеродными молекулярными ситами до тех пор, пока они способны поглощать кислород. После этого поверхность адсорбента необходимо очистить, то есть регенерировать, путем сброса давления или повышением температуры. А воздух направляется во вторую колонну. В это время азот проходит сквозь агрегат и накапливается в ресивере. Продолжительность циклов адсорбции и регенерации составляет всего несколько минут. Чистота получаемого по данной технологии азота составляет 99,9995%.
Преимущества адсорбционных установок:
- быстрый пуск и остановка;
- возможность дистанционного управления;
- высокая разделительная способность;
- низкое энергопотребление;
- возможность оперативной переналадки;
- автоматическое регулирование режима;
- низкие затраты на обслуживание.
Применение
Газообразный азот
Промышленное применение газообразного азота обусловлено его инертными свойствами. Газообразный азот пожаро- и взрывобезопасен, препятствует окислению, гниению. В нефтедобывающей промышленности газообразный азот применяется для обеспечения безопасного бурения, используется в процессе капитального и текущего ремонта скважин. Кроме того, газообразный азот высокого давления используют в газовых методах повышения нефтеотдачи пласта. В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений. В горнодобывающем деле азот может использоваться для создания в шахтах взрывобезопасной среды, для распирания пластов породы, тушения эндогенных пожаров. В производстве электроники азот применяется для продувки областей, не допускающих наличия окисляющего кислорода. Если в процессе, традиционно проходящем с использованием воздуха, окисление или гниение являются негативными факторами, азот может успешно заместить воздух.
Газообразным азотом заполняют камеры шин шасси летательных аппаратов. Кроме того, в последнее время заполнение шин азотом стало популярно и среди автолюбителей, хотя однозначных доказательств эффективности использования азота вместо воздуха для наполнения автомобильных шин нет.
Жидкий азот
Слабокипящий жидкий азот в металлическом стакане
Жидкий азот применяется как хладагент и для криотерапии.
Важной областью применения азота является его использование для дальнейшего синтеза самых разнообразных соединений, содержащих азот, таких, как аммиак, азотные удобрения, взрывчатые вещества, красители и т. п. Более 3/4 промышленного азота идёт на синтез аммиака.. Большие количества азота используются в коксовом производстве («сухое тушение кокса») при выгрузке кокса из коксовых батарей, а также для «передавливания» топлива в ракетах из баков в насосы или двигатели.
Большие количества азота используются в коксовом производстве («сухое тушение кокса») при выгрузке кокса из коксовых батарей, а также для «передавливания» топлива в ракетах из баков в насосы или двигатели.
В пищевой промышленности азот зарегистрирован в качестве пищевой добавки E941, как газовая среда для упаковки и хранения, хладагент, а жидкий азот применяется при разливе масел и негазированных напитков для создания избыточного давления и инертной среды в мягкой таре.
Жидкий азот нередко демонстрируется в кинофильмах в качестве вещества, способного мгновенно заморозить достаточно крупные объекты. Это широко распространённое заблуждение. Даже для замораживания цветка необходимо достаточно продолжительное время. Это связано отчасти с весьма низкой теплоёмкостью азота. По этой же причине весьма затруднительно охлаждать, скажем, замки до −196 °C и раскалывать их одним ударом.
Литр жидкого азота, испаряясь и нагреваясь до 20 °C, образует примерно 700 литров газа. По этой причине жидкий азот хранят в специальных сосудах Дьюара с вакуумной изоляцией открытого типа или криогенных ёмкостях под давлением. На этом же факте основан принцип тушения пожаров жидким азотом. Испаряясь, азот вытесняет кислород, необходимый для горения, и пожар прекращается. Так как азот, в отличие от воды, пены или порошка, просто испаряется и выветривается, азотное пожаротушение — самый эффективный с точки зрения сохранности ценностей механизм тушения пожаров.
Заморозка жидким азотом живых существ с возможностью последующей их разморозки проблематична. Проблема заключается в невозможности заморозить (и разморозить) существо достаточно быстро, чтобы неоднородность заморозки не сказалась на его жизненных функциях. Станислав Лем, фантазируя на эту тему в книге «Фиаско», придумал экстренную систему заморозки азотом, в которой шланг с азотом, выбивая зубы, вонзался в рот астронавта и внутрь его подавался обильный поток азота.
В качестве легирующей добавки к кремнию, образует высокопрочное соединение (керамику) нитрид кремния, обладающее высокой вязкостью и прочностью.
Ссылки
Получение и применение азота
Получение азота:
- промышленным способом азот получают сжижением воздуха с последующим отделением азота путем испарения;
- лабораторные способы получения азота:
- разложением нитрита аммония: NH4NO2 = N2 + 2H2O;
- восстановлением азотной кислоты активными металлами: 36HNO3 + 10Fe = 10Fe(NO3)3 + 3N2 + 18H2O;
- разложением азидов металлов (чистый азот): 2NaN3 → (t) 2Na + 3N2;
- атмосферный азот получают реагированием воздуха с раскаленным коксом: O2 + 4N2 + 2C → 2CO + 4N2;
- пропусканием аммиака над оксидом меди (II) при t=700°C: 2NH3 + 3CuO → N2 + 3H2O + 3Cu.
Применение азота:
- создание инертных сред в металлургии;
- синтез аммиака и азотной кислоты;
- производство взрывчатых веществ;
- для создания низких температур;
- производство минеральных удобрений: калийная селитра (KNO3); натриевая селитра (NaNO3); аммонийная селитра (NH4NO3); известковая селитра (Ca(NO3)2).
Влияние на сельскохозяйственные культуры
Азотным удобрениям принадлежит ведущая роль в повышении урожайности различных сельскохозяйственных культур
Это связано с ролью азота как важного биологического элемента, играющего исключительную роль в жизни растений
Достаточное снабжение азотом усиливает синтез органических азотистых веществ. У растений образуются мощные листья и стебли, интенсивность зеленой окраски усиливается. Растения хорошо растут и кустятся, улучшается формирование и развитие органов плодоношения. Эти процессы способствуют повышению урожайности и содержанию белка.
Однако необходимо учитывать, что односторонний избыток азота может задерживать созревание растений, способствуя развитию вегетативной массы при уменьшении развития зерна, корнеплодов или клубней. У льна, зерновых и некоторых других культур избыток азота вызывает полегание (фото) и ухудшение качества растениеводческой продукции.
Так, в клубнях картофеля может снизиться содержание крахмала. В корнеплодах сахарной свеклы снижается сахаристость и возрастает содержание небелкового азота.
[править] История открытия
В работе «Химический трактат о воздухе и огне» шведский химик К. Шееле описал получение и свойства «огненного воздуха» и отметил, что атмосферный воздух состоит из двух «видов воздуха»: «огненного» — кислорода и «флогистованого» — азота. Однако приоритет открытия кислорода принадлежит Джозефу Пристли, потому что труд Шееле был опубликован только в 1777 году.
В 1772 году азот (под названием «испорченного воздуха») как простое вещество описал Даниэль Резерфорд, он опубликовал магистерскую диссертацию, где указал основные свойства азота (не реагирует со щелочами, не поддерживает горения, непригоден для дыхания). Именно Даниэль Резерфорд и считается первооткрывателем азота.
Характеристики азота
Использование азота в промышленности возможно в жидкой и газообразной форме. Получают материал мембранным, криогенным и адсорбционным способами. Последний вариант является наиболее востребованным при получении больших объемов азота, обладающего следующими характеристиками:
- Минимальная теплоемкость, отсутствие токсичных испарений.
- Способность препятствовать процессам развития коррозии, гниения и окисления
- Противопожарная и взрывобезопасность.
- Инертность и низкая температура кипения, равная 196 градусам.
- Способность вытеснять кислород.
- Возможность оперативной заморозки любой продукции без образования кристаллов льда.
Азот практически не растворяется в воде и других жидкостях, не проводит тепловую и электрическую энергию, а его содержание в атмосфере составляет 75%. Благодаря подобным характеристикам газ имеет большое практическое значение, количество вариантов использования материала постоянно растет.
Количество азота в различных видах удобрений
Минеральные
минеральные удобрения
В состав первых входит один основной химический элемент и несколько других в незначительных количествах. В составе комплексных до 3-х основных элементов и несколько дополнительных в небольших количествах.
Каждый вид азотосодержащих удобрений отличается долей содержащегося азота от общей массы.
Простые минеральные удобрения:
Аммиачные:
- жидкий аммиак — 82,3%;
- водный аммиак — 17-21%;
- сульфат аммония — 20,5%;
- хлористый аммоний — 24-25%;
Нитратные:
- натриевая селитра — 16,4%;
- кальциевая селитра — 13,5-15,5%;
 Комплексные:
Комплексные:
Аммиачно-нитратные:
- аммиачная селитра — 34-35%;
- известково-аммиачная селитра — 20,5%;
- аммиакаты на основе аммиачной селитры — 34,4 -41%;
- аммиакаты на основе кальциевой селитры — 30,5-31,6%;
- сульфонитрат аммония — 25,5-26,5%.
Фосфорные

Фосфорные удобрения
Двухкомпонентные:
- азотофосфат — 33% азота (N), 3-5% фосфора (P);
- аммофосфат — 6% (N), 45-46% (P);
- диаммонийфосфат — 18% (N), 46% фосфатов;
- аммофос — 11-12% (N), 44-50% фосфорной кислоты (H₃PO₄);
- нитрофосфат — 32-33% (N), 1,3-2,6% (P).
Трехкомпонентные:
- суперфос-NS- 12% (N), 25%(H₃PO₄) , 25% серы (S);
- нитрофоска — 12-17% (N), 12-17% (P), 12-17% калия (K);
- аммофоска — 12% (N), 15% (P), 15% (K), 14% (S);
- диаммофоска — 10% (N) (аммонийная форма), 26% (H₃PO₄), 26% (K).
Фосфорно-калийные удобрения не содержат хлора и натрия, поэтому подходят для подкормки любых овощей, ягод, фруктов.
Карбамид
- мочевина — 46% азота;
- мочевина-формальдегид — 38-42%;
- аммиакаты на основе карбамида — 37-40%.
Прежде чем внести удобрение в почву, необходимо рассчитать его количество. Для этого нужно знать состав почвы, содержание в ней азота, необходимую норму потребления его для растений, подкормка которых планируется.
Население
Первыми жителями современного города стали евреи-выходцы из арабских стран, репатриировавшиеся в Израиль в конце 1950-х и 1960-е годы. В 70-е годы XX века Ашдод стал главным местом расселения грузинских евреев. В городе живут несколько десятков тысяч ортодоксальных евреев. С 1990 года по 2000 год население города выросло с 60 000 до 200 000 человек.
По данным Центрального статистического бюро Израиля, население на начало 2020 года составляло 225 939 человек. На 2019 год Ашдод являлся шестым по наcелению городом Израиля.
В 2018 году 89,7 % населения составляли евреи.
Естественный прирост населения составляет 0,8 %.
29,1 % населения — репатрианты, приехавшие после 1990 года; город был одним из центров, где оседали репатрианты из СНГ, в 2014 году они составляли 26 % населения.
57,4 % выпускников школ получили аттестат зрелости, 25,0 % населения имеют свидетельство о высшем образовании. Средняя зарплата на 2017 год составила 8564 шекеля.









